قوانین الکترولیز فارادی (آموزش قانون الکترولیز فارادی)

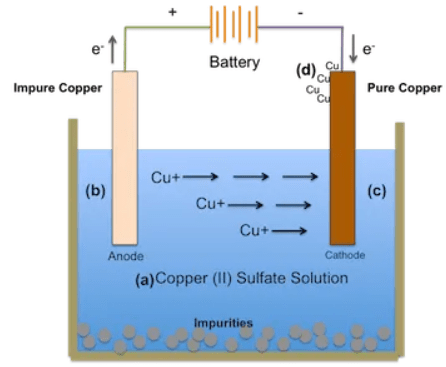
قبل از درک قوانین الکترولیز فارادی، ابتدا باید فرآیند الکترولیز یک سولفات فلز را درک کنیم.
هرگاه یک الکترولیت مانند سولفات فلز در آب رقیق شود، مولکول های آن به یون های مثبت و منفی تقسیم می شوند. یون های مثبت (یا یون های فلزی) به سمت الکترود های متصل به ترمینال منفی باتری حرکت می کنند و الکترون ها را جذب می کنند و به یک اتم فلز خالص تبدیل می شوند و روی الکترود رسوب می کنند.
یون های منفی به سمت الکترود متصل به ترمینال مثبت باتری حرکت می کنند و الکترون های اضافی خود را آزاد کرده و به رادیکال SO4 تبدیل می شوند. از آنجایی که SO4 نمی تواند در حالت خنثی الکتریکی وجود داشته باشد، به الکترود مثبت فلزی حمله می کند و یک سولفات فلزی تشکیل می دهد که دوباره در آب حل می شود.
قوانین الکترولیز فارادی روابط کمی (ریاضی) هستند که دو پدیده فوق را توصیف می کنند.
قانون اول الکترولیز فارادی
با توضیح بالا، واضح است که جریان جاری از مدار باتری خارجی کاملاً به تعداد الکترون هایی که از الکترود یا کاتد منفی به یون یا کاتیون های فلزی مثبت منتقل می شوند بستگی دارد.
اگر کاتیون ها مانند ++Cu دو ظرفیت داشته باشند، برای هر کاتیون، دو الکترون از کاتد به کاتیون منتقل می شود.
می دانیم که هر الکترون دارای بار الکتریکی منفی 19-^10×1.602- کولن است و برابر با e- می باشد. بنابراین برای قرارگیری هر اتم مس به روی کاتد، 2e- انتقال بار از کاتد به کاتیون باید وجود داشته باشد.
به طور کلی برای زمان t، تعداد کل n اتم مس روی کاتد رسوب می کند، بنابراین کل بار منتقل شده 2ne- کولن خواهد بود. جرم m مس ته نشین شده تابعی از تعداد اتم های رسوب شده است. می توان نتیجه گرفت که جرم مس ته نشین شده با مقدار بار الکتریکی که از الکترولیت عبور می کند، نسبت مستقیم دارد.
m ∝ Q
قانون اول الکترولیز فارادی بیان می کند که رسوب شیمیایی ناشی از عبور جریان از یک الکترولیت با مقدار الکتریسیته (کولن) عبوری از آن نسبت مستقیم دارد.
جرم رسوب شیمیایی برابر است با:
![]()
که در آن، Z ثابت تناسب است و به عنوان معادل الکتروشیمیایی ماده شناخته می شود.
اگر در معادله بالا Q = 1 کولن قرار دهیم، Z = m به دست می آید که به این معنی است که معادل الکتروشیمیایی هر ماده، برابر با مقدار رسوب شده همان ماده در عبور 1 کولن بار الکتریکی است. Z بر حسب میلی گرم بر کولن یا کیلوگرم بر کولن بیان می شود.
قانون دوم الکترولیز فارادی
تا اینجا فهمیدیم که جرم ماده شیمیایی که در اثر الکترولیز رسوب می کند، متناسب با مقدار الکتریسیته ای است که از الکترولیت عبور می کند. جرم ماده شیمیایی که در اثر الکترولیز رسوب می کند نه تنها متناسب با مقدار الکتریسیته عبوری از الکترولیت است، بلکه به عوامل دیگری نیز بستگی دارد.
هر ماده ای وزن اتمی مخصوص به خود را دارد. بنابراین مواد مختلف جرم های متفاوتی برای تعداد یکسان اتم خواهند داشت.
همچنین تعداد اتم هایی که روی الکترود ها رسوب می کنند به تعداد ظرفیت آن ها نیز بستگی دارد. هرچقدر ظرفیت بیشتر باشد، برای مقدار الکتریسیته مشخص، تعداد اتم های رسوب شده کمتر خواهد بود و برای ظرفیت کمتر، برای مقدار الکتریسیته مشخص، تعداد اتم های بیشتری رسوب می شود.
بنابراین، برای مقدار یکسانی از الکتریسیته یا باری که از الکترولیت های مختلف عبور می کند، جرم ماده شیمیایی رسوب شده با وزن اتمی آن نسبت مستقیم و با ظرفیت آن نسبت معکوس دارد.
قانون دوم الکترولیز فارادی بیان می کند که وقتی مقدار یکسانی الکتریسیته از چندین الکترولیت عبور می کند، جرم مواد رسوب شده با وزن معادل شیمیایی یا معادل آن ها متناسب است.
معادل شیمیایی یا وزن معادل
معادل شیمیایی یا وزن معادل یک ماده را می توان با قوانین الکترولیز فارادی تعیین کرد و به عنوان وزن آن ماده ای تعریف می شود که با وزن واحد هیدروژن ترکیب می شود یا آن را جایگزین می کند.
بنابراین، معادل شیمیایی هیدروژن برابر یک واحد است. از آنجایی که ظرفیت یک ماده برابر با تعداد اتم های هیدروژنی است که می تواند جایگزین یا با آن ها ترکیب شود، بنابراین معادل شیمیایی به عنوان نسبت وزن اتمی به ظرفیت آن تعریف می شود.

چه کسی قوانین الکترولیز فارادی را اختراع کرد؟
قوانین الکترولیز فارادی توسط مایکل فارادی در سال 1834 منتشر شد.

مایکل فارادی علاوه بر کشف این قوانین الکترولیز، مسئول ایجاد اصطلاحاتی مانند الکترود، یون، آند و کاتد است.













سلام
آیا میتوان رابطه ای بین جرم ماده اکسایش یا کاهش یافته و ولتاژ و آمپراژ و نوع عنصر اکسایش یا کاهش یافته ، به دست آورد؟
مثلا در الکترولیز CuCl2 مذاب ، آیا میتوان سرعت تولید مس و گاز کلر را از طریق رابطه ای به دست آورد؟